Molécules méconnues du grand public, les carraghénanes sont omniprésents dans la vie quotidienne. En effet, ils sont très utilisés dans les industries alimentaires et cosmétiques. Pourquoi les industriels portent -ils un si grand intérêt à cette molécule ? Nous avons d'abord chercher l'origine de ces carraghénanes puis nous avons étudié leur structure et leurs propriétés. Enfin, nous avons cherché leurs applications dans l'alimentaire et le non-alimentaire.
Dans un comté du sud de l'Irlande, appelé Carragheen, les habitants avaient pour habitude d'utiliser une " mousse d'Irlande ", algue qu'ils trouvaient sur les rochers des côtes, pour faire des pommades et des flans. Vers 1700, au cours de la colonisation de l'Amérique du Nord, les Irlandais constatèrent que leur " mousse d'Irlande " poussait également sur les côtes du Massachusetts. Ils se sont par la suite rendus compte que cette algue appartenait à la famille des Rhodophycées (ou algues rouges), et était appelée Chondrus crispus.
On rencontre cette algue rouge sur toutes les côtes de l'Atlantique Nord surtout dans les provinces maritimes du Canada, le Maine, la Bretagne et la péninsule Ibérique. En Bretagne, le Chondrus crispus était appelé " pioka ",sa cueillette se pratique encore les jours de grandes marées.
L'intérêt économique et l'abondance de l'algue, a éveillé l'intérêt des industriels. Ainsi en 1871, le polysaccharide pur, à l'origine des vertus de la " mousse d'Irlande ", est extrait aux Etats-Unis. Il est logiquement appelé carraghénane en référence à son comté d'origine. Après la Seconde Guerre Mondiale, l'expansion de l'industrie alimentaire a engendré une utilisation accrue des carraghénanes en tant que stabilisateurs, épaississants et gélifiants. L'importance de la demande a amené la création de fermes aquacoles destinées à la culture du Chondrus crispus. Celles-ci apportent de nombreux avantages : absence de fluctuations climatiques, une récolte facilitée, des matières premières plus pures et la possibilité de sélectionner les algues les plus productives en carraghénanes.
La France, les Etats-Unis et le Danemark contrôlent à 85% le marché des carraghénanes, dont 12 500 tonnes sont produites par an pour environ 50 000 tonnes d'algues séchées achetées. Les Philippines fournissent 70% de l'approvisionnement mondial en carraghénanes semi-raffinés qui sont moins chers à produire mais autorisés uniquement pour l'alimentation animale. MacDonald avec l'aide du gouvernement des Philippines a obtenu l'accord de la Food and Drug Administration américaine pour les utiliser dans la consommation humaine. Cette utilisation n'est pas encore autorisée dans les pays de l'Union Européenne.
En 1871, le polysaccharide pur est extrait pour la première fois. Le processus d'extraction se déroule en plusieurs étapes.
La récolte s'effectue à la main, sur les côtes, les jours de grandes marées ou par bateaux à l'aide de râteaux. Les algues sont ensuite séchées afin d'obtenir un taux d'humidité inférieur à 20%, ceci afin de préserver la qualité de l'algue et facilité son transport jusqu'à l'usine. Puis, les algues sont mélangées à de l'eau plus ou moins alcaline et sont chauffées à de hautes températures, après filtration, on obtient un liquide contenant des carraghénanes non raffinés. Ce liquide est ensuite centrifugé et le culot obtenu est séché donnant une poudre blanche. Les carraghénanes purs sont obtenus par précipitation dans l'alcool : la poudre est dissoute à chaud dans l'alcool, les impuretés sont solubilisées tandis que les carraghénanes purs sont recristallisés, lors du refroidissement. Différents alcools sont utilisés : méthanol, éthanol et isopropanol. Les polysaccharides utilisés dans l'alimentation sont extraits par une précipitation sélective avec de l'isopropanol : le produit obtenu est alors plus pur et plus concentré.
 II- Structure et propriétés des carraghénanes
II- Structure et propriétés des carraghénanesLes carraghénanes sont des polysaccharides linéaires constitués de molécules de galactoses plus ou moins substitués. La chaîne est constituée de sous-unités appelées carrabioses comprenant deux galactoses liés par une liaison b(1-4). Ces carrabioses sont liés entre eux dans la chaîne par des liaisons a(1-3). De plus, les galactoses sont soient estérifiés par de l'acide sulfurique, soit porteurs d'un pont oxygène entre les carbones 3 et 6 (anhydrogalactose). La présence d'acide sulfurique confère aux carraghénanes un caractère acide marqué.
Les carraghénanes sont des polymères constitués de plus de 1000 résidus galactoses, la probabilité de variations de structures est énorme.
L'identification de la structure chimique des carraghénanes est réalisée suivant des méthodes classiques : oxydation périodique, méthylation, hydrolyse partielle ou totale. La structure conformationnelle est déterminée par : la diffraction des rayons X, la RMN, la spectrométrie de masse et la spectrophotométrie infrarouge. Il est maintenant possible de séparer les différentes formes structurales par électrophorèse ou perméation sur gel.
Il existe différents types de carrabioses dont trois principaux :
On appelle k-carraghénane un polysaccharide constitué de n unités de k-carrabiose. Il en en de même pour les i-carraghénanes et les l-carraghénanes.
Le k-carraghénane est issu des espèces Eucheuma cottonii, Chondrus crispus et Gigartina. Il a pour formule :
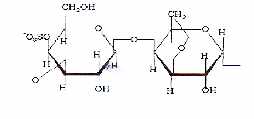
Le i-carraghénane est issu de l'espèce Eucheuma spinosum. Il a pour formule :
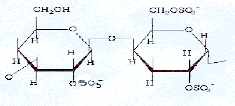
Il a pour formule :
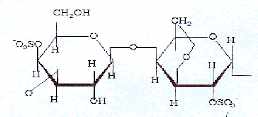
Les différents types de carrabioses confèrent aux carraghénanes des propriétés différentes. Ainsi le k-carraghénane est très gélifiant, le l-carraghénane est stabilisant et épaississant, et le i-carraghénane crée des produits flasques et malléables.
Les carraghénanes ont trois propriétés principales :
La gélification permet la formation d'un gel, c'est à dire une substance colloïdale, de consistance visqueuse qui a tendance à gonfler en absorbant de l'eau.
L'épaississement consiste à augmenter la viscosité d'un liquide sans le rendre solide. La stabilisation rend un produit stable (ne subissant pas de réactions spontanées).
Les carraghénanes sont solubles dans l'eau (le plus souvent à chaud) et insolubles dans la plupart des solvants organiques.
La solubilité des carraghénanes est influencée par différents facteurs :
La solubilité de ces macromolécules est fonction du nombre de groupements sulfate Présent dans la molécule : Plus il y a de groupements sulfate, plus la molécule est soluble. La présence du pont 3,6 anhydrogalactose, résultant de la désulfatation du carbone 6 du carrabiose, diminue donc la solubilité. Les l-carraghénanes ne possédant pas de pont 3,6 anhydrogalactose, sont plus solubles que k et i. Les i-carraghénanes, ayant un groupement sulfate supplémentaire, sont plus solubles que les k-carraghénanes.
Les sels de carraghénanes à Na+ sont généralement plus solubles que les sels à K+. Les k-carraghénanes additionnés d'ions K+ sont considérés comme insolubles dans l'eau froide mais sont solubles à chaud. Avec du sodium, ils se dissolvent aisément dans l'eau froide. Il en est de même pour les i-carraghénanes. Par contre, les l-carraghénanes sont solubles dans l'eau froide quelque soit la force ionique.
L'introduction d'autres solutés dans la solution crée une compétition entre ceux-ci afin d'obtenir une hydratation maximale. Les k-carraghénanes sont les plus sensibles à cette compétition. Les solutés altérant le plus l'hydratation des carraghénanes sont les sels inorganiques. Le saccharose a peu d'effet sur l'hydratation à des concentrations inférieures à 50 %. De même, le glycérol doit être présent en grande quantité pour que ses effets soient visibles. Dans le cas où plusieurs solutés sont présents, leurs effets s'additionnent. Les i-carraghénanes se dissolvent, après chauffage, dans des solutions à concentrations en sels élevées et sont capables de gélifier, alors que les k-carraghénanes en sont incapables.
Les carraghénanes sont difficilement dispersables dans l'eau car les interactions hydrophobes contribuent à la formation d'agrégats que les molécules d'eau ne peuvent pénétrer. La chaleur, fournissant de l'énergie, permet la dispersion et la solubilisation.
Les k et les i-carraghénanes ont la particularité de pouvoir former une hélice gauche en présence de cations (potassiums et calciums), ceci leur permet de créer un gel (il se forme lors du refroidissement de la solution). Les l-carraghénanes en sont incapables. Les k et i-carrabioses possèdent un pont oxygène entre les carbones 3 et 6 du D Galactose. Ce pont résulte de la désulfatation du carbone 6 par une enzyme végétale (isolée de Gigartina stellata), formant alors un anhydrogalactose, et il semble que ce soit ce pont qui est à l'origine de la gélification. On peut également effectuer cette transformation industriellement par une réaction de type SN2 en milieu alcalin.
Formation de l'anhydrogalactose :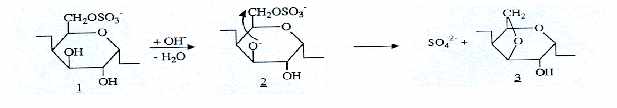
Dans le cas du k-carrabiose, il faut admettre l'existence de deux conformères sous la forme chaise : un où les substituants sont équatoriaux et un où ils sont axiaux. Le pont 3,6 oblige le plan 3,4,5 à se rabattre et le plan 1,2,0 à se relever. La molécule est alors sous la forme du conformère où les subsituants sont axiaux. Pour que la liaison osidique a(1-3) puisse se réaliser avec le k-carrabiose suivant il faut qu'il pivote autour de son axe. Il se forme alors une hélice gauche où tous les groupements sulfates se retrouve du même côté, à l'extérieur de l'hélice. Les chaînes hélicoïdales parallèles s'agrègent grâce à la présence de cations dans la solution, formant une double hélice à l'origine d'un réseau tridimensionnel : le gel.
Le pont oxygène bloque la conformation de l'anhydrogalactose :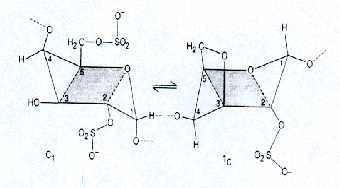
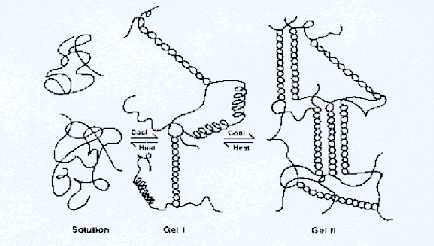
Le l-carrabiose, ne possédant pas ce pont oxygène 3,6 , ne nécessite pas de réarrangement stérique pour réaliser la liaison a(1-3) avec le carrabiose suivant. Il ne forme donc pas d'hélice gauche mais une chaîne où les groupements sulfate sont répartis des deux côtés de celle-ci : il ne peut donc pas être à l'origine d'un gel.
La présence des cations dans la solution de carraghénane va induire la formation d'un gel à une température donnée, appelée température de gélification (Tg). Celle-ci est fonction de la concentration des cations dans la solution.
Les ions potassium sont nécessaires à la gélification car ils permettent la cohésion de deux hélices gauches en double hélice. Un gel de k-carraghénanes contenant uniquement des ions potassium (K+) est élastique, cohésif et transparent. La densité du gel de k-carraghénanes augmente en fonction des concentrations de K+ ainsi plus la concentration en K+ est élevée plus le gel est dense. Les ions K+ augmentent également les températures de fusion et de formation du gel. On peut utiliser différents sels de potassium, le plus efficace étant le chlorure de potassium (KCl) mais il apporte un goût amer au produit final. La dose maximale, dans les plats peu relevés est de 0,1 à 0,2 % de KCl tandis que dans les plats salés, tels que les produits à base de viande, on peut aller jusqu'à 0,5 %. Il remplace alors le chlorure de sodium. Pour des questions gustatives, on utilise du phosphate de potassium, n'apportant pas de goût au produit, et le citrate de potassium donnant un produit plus acide à un pH inférieur à 4. Une autre fonction de ces deux sels est de tamponné la solution à un pH assez élevé où les carraghénanes sont plus stables.
L'addition d'ions sodium dans la solution de k-carraghénanes rétrécit le gel formé et le rend cassant. Si l'on ajoute une quantité importante de sodium, on perturbe alors le processus de gélification des carraghénanes et l'on assouplit le gel.
Les ions calcium (Ca2+) ajoutés à une solution de k-carraghénanes augmentent la rigidité du gel jusqu'à un certain seuil (environ 0,7 % de CaCl2). Leurs effets sont plus prononcés quand ils sont additionnés à des ions K+. On peut penser que les ions Ca2+ créent des interactions ioniques entre deux double hélices adjacentes, ce qui stabilise et densifie le réseau du gel. Contrairement aux k-carraghénanes, les i-carraghénanes forment un gel très élastique et très cohérent en présence des ions Ca2+. Le gel de i-carraghénanes est le seul qui reste stable lors d'un cycle de congélation-décongélation car la synérèse n'a pas lieu dans ce gel.
La densité, la texture et la température de gélification sont influencées par d'autres solutés que les sels comme le saccharose. Celui-ci provoque l'augmentation de la température de gélification et de fusion.
L'association de k-carraghénanes et d'autres gommes est utilisée afin d'obtenir la texture de la gélatine dans l'alimentation.
Lorsque l'on ajoute de la gomme de caroube aux k-carraghénanes, la résistance du gel augmente. La résistance maximale est atteinte quand la quantité de gomme ajoutée est égale à la quantité de k-carraghénanes. Sa rigidité augmente également et est maximale en présence de 0,25 % de gomme de caroube. Tandis que la cohésion du gel augmente avec la quantité de gomme ajoutée, celle-ci rend le gel de k-carraghénanes moins cassant et plus élastique, approchant ainsi la texture de la gélatine. Contrairement aux gommes de caroube, l'ajout de i-carraghénanes dans la solution de k-carraghénanes diminue de manière significative la densité et la résistance du gel, l'effet est proportionnel à la quantité de i-carraghénanes ajoutées. Les i-carraghénanes diminuent la synérèse du gel.
L'addition de gommes de xanthane rend le gel de k-carraghénanes plus mou, plus cohésif et plus élastique. De plus, comme les i-carraghénanes, elles diminuent également la synérèse du gel.
Un pH acide ou des agents oxydants peuvent rompre les liaisons osidiques du polysaccharide. Cette hydrolyse acide dépend du pH, de la température et du temps. Afin d'altérer le moins possible les carraghénanes, le chauffage doit s'effectuer à haute température et être très rapide.Les solutions de carraghénanes ont une stabilité maximale à pH 9 et le processus de gélification ne peut avoir lieu à des pH inférieurs à 3,5.
L'hydrolyse acide des carraghénanes n'a lieu que lorsque ceux-ci sont en solution et elle est accélérée avec l'augmentation de la température et la diminution du temps de chauffage. La dénaturation des carraghénanes par l'hydrolyse acide ne peut donc pas avoir lieu lorsque ceux-ci sont sous la forme gélifiée.
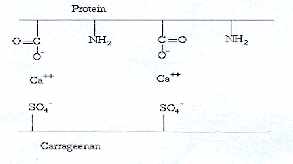
Les groupements sulfate des carraghénanes sont chargés négativement dans la gamme de pH des produits alimentaires. Ces polysaccharides peuvent donc interagir avec d'autres molécules chargées positivement comme des protéines. Ce qui peut stabiliser le gel. Cette interaction avec des protéines dépend du pH et du pH isoélectrique de la protéine.
 III- Applications industrielles
III- Applications industrielles L'union européenne a répertorié les carraghénanes comme additifs alimentaires sous la nomenclature E407.
Les carraghénanes sont traditionnellement utilisés dans l'industrie laitière car ils interagissent avec la k-caséine du lait pour former un gel. La k-caséine a un pH isoélectrique de 4,4. En dessous de ce pH, la protéine est chargée positivement et interagit avec les carraghénanes chargés négativement. La présence d'ions Ca2+ favorise la gélification par formation de ponts Ca2+ entre les molécules.
Les i-carraghénanes sont utilisés pour stabiliser les soupes (la viscosité des soupes à froid disparaît après chauffage). Ils sont en pleine expansion dans le marché de la viande, aux Etats-Unis. La caractère chargé des carraghénanes stabilise les émulsions eau-graisse pendant la préparation, la cuisson et le stockage. Il en résulte une viande de meilleur qualité. On trouve également les carraghénanes dans : la bière, le vin, le pain, les glaces, les sauces.
Bien que très employé dans l'alimentation, ils sont présents dans les domaines de la cosmétique, du textile, de la pharmacologie. La principale application en cosmétique est le dentifrice. Les carraghénanes stabilisent l'émulsion de la pâte de dentifrice en bloquant l'abrasif à l'intérieur de la matrice du gel. Les carraghénanes intéragissent aussi avec les caroténoïdes afin de donner une peau douce et des cheveux soyeux. Les carraghénanes étant des produits naturels, les produits à base de ceux-ci peuvent être nommer, produit naturel. Les gels denses que forment les carraghénanes permettent la diffusion rapide de solutés, Ceci permet leur utilisation dans les biotechnologies. Ces extraits d'algues peuvent également être utiles en pharmaceutique où ils servent d'anti-acide et de protecteurs des parois stomacales et intestinales.
Les carraghénanes permettent de créer des gels d'aspects et de consistances différents ainsi que d'épaissir et de stabiliser les aliments. Cet éventail de possibilités les rend très attractifs pour l'industrie alimentaire mais également pour la cosmétique, l'industrie textile et les biotechnologies. Au Sénégal, ce polysaccharide présent sur les côtes et non exploité pourrait aider au développement du pays. Des recherches sont en cours à l'université du Nouveau-Brunswick afin d'augmenter la qualité des algues au Sénégal et permettre leur commercialisation. Cependant, des risques de toxicité à fortes doses sont à l'étude. Les k-carraghénanes seraient à l'origine de thromboses et de cancers du colon chez le rat.
